引言
3D打印又稱增材制造,是快速成型技術的一種,以數字模型文件為基礎,將可黏合材料使用逐層打印的方法構造物體的技術[1]。而生物3D打印技術則是在此基礎上與生物醫學相結合產生的一種新興技術[2]。它是以細胞、活性分子和生物材料為基本成型單元,通過受控組裝完成器官、組織和仿生產品的制造科學和技術的總稱[3],是傳統制造行業轉向高端制造產業的關鍵技術之一,也是制造學科與醫學、信息、生物和材料等學科交叉融合的一個新興研究方向,可應用于骨科、心腦血管、口腔醫學、皮膚科、神經外科、藥物篩選以及藥物控釋等方面,具有廣闊的應用前景[4-11]。

近年來,隨著科學技術的發展,生物3D打印的各種新興技術層出不窮,按照打印原理的不同生物3D打印技術可細分為光固化生物3D打印技術、擠出式生物3D打印技術、噴墨式生物3D打印技術以及激光直寫式生物3D打印技術[12-14]。
光固化生物3D打印技術是通過光選擇性交聯生物墨水使其固化的方式進行打印,根據成型方式的不同分為立體光刻(SLA)和數字光處理(DLP)。
本研究主要介紹了DLP生物3D打印技術,并對其應用進行綜述。
1、DLP生物3D打印技術概念
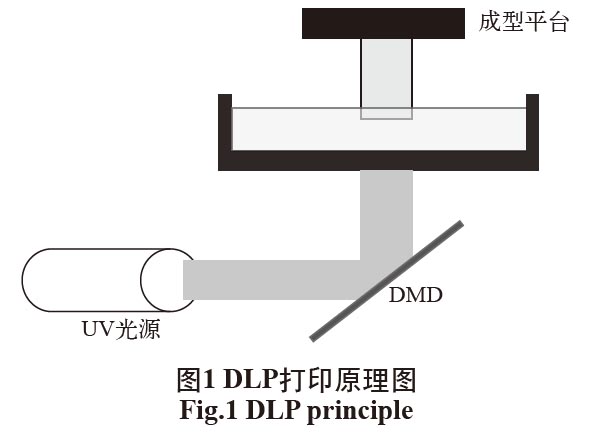
DLP生物 3D打印技術是將影像信號經過數字處理后,經過數字微鏡元件(DMD)光投影出來,完成數字信息顯示的技術,其打印原理是通過光選擇性交聯生物墨水固化成型的方法進行打印。基于這種技術開發了DLP 生物3D打印技術。相較于SLA類型打印機使用的點光源,DLP類型打印機采用的是面光源,如圖1所示。紫外光透過DMD形成二維圖案,
照向光固化的生物墨水,具有特定圖案的紫外光與溶解的自由基光引發劑相互作用使生物墨水固化成特定的圖案,然后移動打印平臺,在下一層重復這一過程。這種打印技術利用面光源對可見光交聯生物墨水進行固化,單次照射即可成型一個面,而且僅需要一個軸移動,設備結構簡單,易于控制,打印速度快,成型精度高[15-16]。
2、DLP生物3D打印材料
由于DLP生物 3D打印技術的控制原理簡單、使用的材料生物相容性較高、打印條件溫和、能夠構建復雜的微小組織結構等原因,十分適合生物3D打印。而這一技術的應用與發展對打印材料也提出了更高的要求,不僅要滿足光固化的要求,固化后還要具有一定的機械強度,以及能夠支持細胞生長、增殖和黏附等過程的生理環境,因此光固化的生物墨水的研發也十分重要[17-18]。
傳統的光固化打印設備是利用紫外光固化光敏材料,形成固體或凝膠[19]。組織工程上常用生物相容性較好的水凝膠作為打印材料,主要由可聚合的低聚物和自由基光引發劑組成。材料的固化過程主要是三個步驟,首先受到紫外光照射形成自由基,然后自由基與單體的雙鍵結合形成交聯網絡,最后隨著交聯過程中共價鍵的形成而終止聚合過程。自由基光引發劑是固化材料的重要組分,受到光照之后能夠分解為自由基或陽離子,而引發聚合反應[20-22]。常用的光固化生物材料一般分為天然生物材料、合成生物材料和復合生物材料。其中天然生物材料有甲基丙烯酸明膠(GelMA)、硫醇-烯明膠[4]、絲素蛋白[23]等。合成生物材料有聚乙二醇二丙烯酸酯(PEGDA)[24]、聚碳酸酯丙烯酸酯及其衍生物[25-27]。一般使用苯基-2, 4, 6-三甲基苯甲酰膦酸鋰(LAP)、I2959等作為光引發劑[28]。
3、DLP生物3D打印技術在醫學領域的應用
DLP 生物3D打印技術由于其良好的成型性,受到愈來愈多的關注,在醫學領域具有廣泛的應用場景,具體應用場景見表1。

3.1 仿生牙齒及牙髓修復
DLP打印技術由于其獨特的成型特點,其精度受DLP投影光機的分辨率、成型范圍以及單次固化層厚的影響,投影光機分辨率越高、成型范圍越小且層厚越小打印精度就越高。因此DLP打印技術適合打印高精度的小形物品,在定制個性化牙科器械方面具有得天獨厚的優勢。多普勒實驗室材料科學與技術研究所的Sonja Baumgartner團隊[38]提出了一種利用DLP打印技術制造仿生牙齒的方法,經實驗證明利用該方法打印的牙齒可以滿足醫用修復體所需精度以及生物相容性。牙髓組織位于牙齒內部的牙髓腔內,包括神經、淋巴、血管和早牙本質細胞等,具有感覺、保護、營養以及形成牙本質的能力。由于牙髓組織被堅硬的牙本質包裹,沒有有效的側枝循環等,導致牙髓發生炎癥或受到損傷后難以恢復。
傳統的治療方法是使用根管治療,這種方式可能會導致牙髓壞死、牙齒斷裂等,存在一定的風險。浙江大學醫學院歐陽宏偉教授團隊[29]采用DLP打印技術構建搭載間充質干細胞(hDPSC)的GelMA微球為細胞提供有利的增殖環境。hDPSC在體內具備形成血管與神經以及牙本質細胞的能力,可用于構建組織工程牙髓使牙髓再生,是治療牙髓疾病理想的
治療方法。因此,DLP生物3D打印技術在定制個性化齒具以及制造包裹著細胞的載細胞微球方面有著一定的優勢,也為治療牙齒疾病提供了理想的治療方法。
3.2 組織工程軟骨修復和再生
軟骨缺損的修復在臨床治療中具有很高的挑戰性。由于生物3D打印技術具有優秀的個性化定制的特點,這種技術為組織工程軟骨再生和修復提供了新思路[39-40]。支架是組織工程的核心,對軟骨再生有著至關重要的影響[41]。臨床上要求,軟骨組織工程支架要有良好的生物相容性,使支架能夠植入病患體內,細胞能夠在支架上生長增殖,并且支架能夠在體內降解[42-43],而DLP生物3D打印技術使用的生物墨水恰好滿足這一特性[44-45]。四川大學華西醫院的茍馬玲及其團隊[30]設計了一種無創的體內生物3D打印方法。這種方法是將光聚合的生物墨水注射到體內,再使用具有特定圖案的近紅外光照射使其在體內原位固化成型。并且利用該方法打印出了一個可用于軟骨修復的個性化的耳軟骨支架。該研
究為體內原位生物打印提供了實例驗證,為醫學生物3D打印提供了新的方法,推動了原位微創打印的發展。
人體骨組織除了具有支撐、保護和運動的作用,還有造血及新陳代謝的作用[31]。由于人體的骨組織結構復雜,傳統的支具并不能很好地代替天然骨。理想的情況是使損傷部位再生或者制造能夠生長增殖、具有血運的仿生骨組織結構。而通過3D打印的方法,模擬天然復雜的骨組織結構進行組織再生,也為組織工程再生提供了一種新的研究方法。
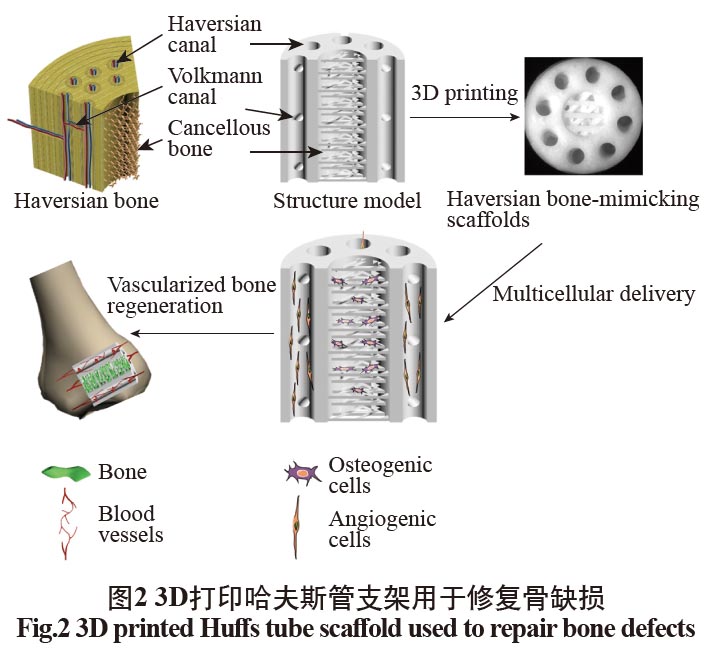
陳清華[46]使用具有生物活性的羥基磷灰石,利用光固化生物3D打印技術制造出復雜多孔仿生骨修復支架,促進骨組織修復,并恢復其功能。組織工程支架的結構對于模擬天然骨組織具有重要的意義,中國科學院上海硅酸鹽研究所的吳成鐵教授團隊[47]利用DLP打印技術,將生物陶瓷材料制成具有復雜結構的哈弗斯管支架,如圖2所示,支架的抗壓強度和孔隙率可以通過更改哈夫斯結構的參數來控制。并通過對其進行體外誘導成骨、生成血管和分化神經,發現其在體內體外都有著良好的輸送細胞的能力,可以加速成骨和血管再生,這項研究通過模擬天然復雜的骨組織結構進行組織再生,為組織工程再生提供了一種新的研究方法。
3.3 神經組織修復
神經組織是神經系統的基本組成部分之一,結構及其功能都十分復雜,當神經組織受到損傷后由于其微小且復雜的結構,使用傳統的治療方法難以進行修復。而光固化打印技術可以制造微小精密的水凝膠結構,可以用來制造用于修復神經組織的神經導管,為修復神經組織提供了一種理想的方法。
近年來,使用3D打印技術制造可降解的神經組織導管引導神經組織修復的方法成為熱點。由于DLP技術的發展,可制造高分辨率、高精度的微小水凝膠結構,因此也適用于神經組織的修復。浙江大學醫學院附屬兒童醫院葉文松主任團隊[32]研發一種以GelMA為打印材料,LAP為光引發劑,通過DLP技術用于打印周圍神經再生的神經導管的方法。其團隊
在研究中利用DLP生物打印技術成功制備了不同內徑的多通道神經導管支架,并通過體外培養實驗證明,神經細胞可以沿神經導管存活、增殖和遷移,神經導管具有良好的生物相容性而且可以引導周圍神經修復,在神經組織再生方面具有巨大的潛力。脊柱骨折或錐體錯位會導致脊髓或神經壓迫和挫傷,難以完全治愈。美國加州大學神經科學教授Mark
Tuszynski和納米工程系陳紹琛教授團隊合作[48],利用一種微型連續投影光固化打印的方法制造復雜的中樞神經系統結構,促進損傷的神經組織修復。并在研究中將支架植入大鼠脊髓損傷的位置,幾個月后大鼠損傷的脊髓組織被修復,且運動能力恢復。
3.4 藥物控釋
DLP 生物3D打印技術能夠制造具有獨特結構的產品,可用于個性化植入,在個性化醫療領域是一種很有前途的技術,應用前景十分廣闊。近些年來,DLP技術在藥物控釋方面也有一定的進展。貝爾格萊德大學藥學院Mirjana Krkobabić教授團隊[33]以撲熱息痛(對乙酰氨基酚)為模形藥物,PEGDA為光聚合物,二苯基(2,4,6-三甲基苯甲酰基)氧化膦為光引發劑,利用DLP技術制備口服藥物固體制劑,在其中加入合適的造孔劑打印藥物釋放效率可控的撲熱息痛片和茶堿控釋片。浙江工業大學楊根生教授及其團隊[34]使用PEGDA為光聚合物,二苯基(2,4,6-三甲基苯甲酰基)氧化膦為光引發劑,利用DLP技術制造了可用于藥物傳遞和控釋的內植物。
生長因子在組織再生過程中有著十分關鍵的作用,調節生長因子的釋放與傳遞速率可以加快組織工程再生。加州大學圣迭戈分校的陳紹琛教授團隊[49]提出了一種利用DLP 生物3D打印技術制備出有著獨特結構的水凝膠,從而控制水凝膠中生長因子釋放速率的方法,驗證了優先釋放指定生長因子的可能性。將藥物制造成特殊結構的固體制劑可以控制藥物靶向定量釋放,而光固化技術在制造微小的精密結構方面具有一定優勢。因此,可以利用這種技術制造藥物控釋片。
3.5 仿生皮膚
皮膚是人體最大的器官,容易損傷,造成感染[50]。
由于皮膚自我修復能力有限,當其受到嚴重損傷時,難以完全愈合。因此當皮膚受到嚴重損傷時需要供體皮膚移植治療。但是,由于供體皮膚來源有限,且異體移植可能會造成排異或感染,因此,利用3D打印技術制造仿生皮膚有著廣闊的前景,DLP技術由于其面成型的原理,比較適合皮膚打印[51]。
浙江大學醫學院歐陽宏偉教授團隊[35]提出了一種利用仿生生物墨水和DLP 生物3D打印技術打印仿生活性皮膚的新方法,團隊使用GelMA與丁酰胺交聯的透明質酸,并以LAP為光引發劑,組成凝膠生物墨水,并通過DLP打印技術制造了仿生皮膚,并在體內實驗中證明該方法制造的活性皮膚具有皮膚的功能,而且可以促進真皮再生和血管形成。光固化
生物3D打印技術在制造仿生皮膚方面有著一定的優勢。而現階段這項技術的關鍵除了打印設備,更重要的是所使用的生物材料,不僅具有良好的生物相容性,而且能夠促進細胞在人體裸漏的皮膚表面生長增殖,最后能夠分解或被人體吸收。
3.6 氣管支架
氣管的病變會引起人體呼吸系統疾病,造成呼吸困難,嚴重可危及生命。當氣管發生堵塞時一般采用植入氣道支架的治療方法。傳統的氣道支架是硅膠管,植入和移除比較困難,可能會對人體內其他組織造成損傷[52-53]。因此,利用生物3D打印技術制造的可降解生物支架應運而生[54]。而DLP技術由于其打印模型精度更高、尺寸更小,蘇黎世聯邦理工
學院的Nevena Paunović等[36]提出了一種利用DLP生物3D打印技術制造雙聚合物生物支架的方法,并利用該方法制造了支架,研究發現該支架具有可調的彈性性能、適當的生物降解性和良好的生物相容性。韓國翰林大學醫學院的Chan Hum Park團隊[55]首次合成了甲基丙烯酸縮水甘油酯改性絲素蛋白(Silk-GMA)用于光固化生物打印,研究發現這種材料具有良好的光固化打印能力、成軟骨能力以及軟骨所需要的力學性能。研究人員展示了將含有兔軟骨細胞的Silk-GMA水凝膠打印的人工氣管植入氣管缺損的兔體內的實驗,結果表明凝膠支架能夠替代氣管的缺損部分使氣管再生[56]。浙江大學機械工程學院的姚鑫驊團隊[57]提出了利用DLP生物3D打印技術,制備一種帶有纖毛上皮的柔性多孔手性氣管支架,以減少氣管支架植入帶來的并發癥。該支架與普通硅膠支架相比具有更好的抗移性和通氣性,內壁上的纖毛上皮也可以防止黏液堵塞。北京航空航天大學樊瑜波教授等[58]利用DLP技術制造了丙烯酸酯材料的氣管支架并用魚鱗膠原蛋白將其表面進行改性,提高了氣管支架的生物相容性。并通過水接觸角實驗和細胞培養證明了該復合氣管支架的生物相容性良好。
3.7 腫瘤治療
腫瘤是一個具有多種細胞類型的復雜生態系統,是包含多種細胞類型以及相互作用的復雜組織。目前,大多數癌癥的藥物篩選都是使用2D培養腫瘤細胞和動物模型進行評估,這種模型的反應與人的反應并不匹配[59]。而利用光固化生物3D打印的方法構建仿生組織模形相較于傳統的2D培養可以更明顯的展示出腫瘤的生長增殖情況、藥物作用機理以及免疫相互作用等,為未來癌癥治療提供了新思路[60]。DLP技術相較于其他種類的打印方式精度更高、可打印結構更復雜,因此適合打印細胞瘤這種復雜結構。Jeremy N. Rich等[37]利用DLP 生物3D打印和可見光交聯的天然細胞外基質衍生物構建了膠質母細胞瘤的3D仿生微環境。這有助于人們研究腫瘤與免疫的相互作用,尋找治療方法。也可用于高通量的藥物篩選工作,推動了腫瘤治療的發展,為攻克腫瘤這一難題開拓了視野。
4、結語與展望
生物3D打印技術是傳統增材制造與生物醫學相結合的新興技術,是傳統制造行業轉向高端制造領域的標志性技術,是多學科交叉融合的新興研究方向,可用于制造新形植入物、仿生器官以及病理模型等,對于傳統制造行業和生物醫療都是一場新的變革。本文著重討論了DLP生物3D打印技術研究現狀,并綜述了其在仿生牙齒、軟骨再生、神經組織修復、藥物控釋、仿生皮膚、氣管支架、腫瘤治療等方面的應用。這種技術由于其良好的生物相容性且打印均勻、精度高、速度快,為組織工程修復和再生方面提供了新的研究思路,為新型生物制造技術的發展開辟了新的道路。但本文僅寬泛的討論了DLP生物3D打印技術在醫學領域的應用情況,對于光源設計、設備結構設計和材料具體性質等情況未進行針對性介紹。
盡管DLP生物3D打印技術發展迅速,已經能夠制造出高度仿生,具有生物活性的組織結構,但是大部分的研究都處于實驗室的動物實驗身上,真正可用于移植的人體器官并應用于臨床仍面臨巨大的挑戰。目前這種技術所使用的打印材料主要聚焦于生物凝膠,用于制造具有功能性的組織。然而,誘導植入物分化為功能性組織仍然存在一定瓶頸。此外,對于生物3D打印的標準體系仍然不健全,而且醫療準入制度的門檻也比較高。這些原因也限制了生物3D打印技術應用于臨床。因此,要想這項技術在醫學領域大放異彩,不僅需要開發具有良好生物相容性、可降解性、生物力學性能的材料,也要建立更加完善、更加健全的標準體系和監管措施。
參考文獻
[1] 賀永, 高慶, 劉安, 等. 生物3D打印——從形似到神似[J]. 浙江大學學報:工學版, 2019, 53(3): 6-18.
HE Yong, GAO Qing, LIU An, et al. 3D Bioprinting:from Structure to Function [J]. Journal of ZhejiangUniversity (Engineering Science), 2019, 53(3): 6-18.
[2] CARLOS M, SANDRA C, B B M, et al. Bioprinting:from Tissue and Organ Development to in VitroModels [J]. Chemical Reviews, 2020, 120(19):10547-10607.
[3] CHUN H J, REIS R L, MOTTA A, et al. BiomimickedBiomaterials [M]. Springer, Singapore, 2020, DOI:10.1007/978-981-15-3262-7.
[4] YU C, MILLER K L, SCHIMELMAN J, et al.A Sequential 3D Bioprinting and OrthogonalBioconjugation Approach for Precision TissueEngineering [J]. Biomaterials, 2020: 120294.
[5] OZBOLAT I, YU Y. Bioprinting toward OrganFabrication: Challenges and Future Trends [J]. IEEETransactions on Biomedical Engineering, 2013, 60(3):691-699.
[6] MAGIN C M, ALGE D L, ANSETH K S. Bio-inspired3D Microenvironments: A New Dimension in TissueEngineering [J]. Biomedical Materials, 2016, 11(2):022001.
[7] GU Z, FU J, LIN H, et al. Development of 3DBioprinting: from Printing Methods to BiomedicalApplications [J]. Asian Journal of PharmaceuticalSciences, 2020, 15(5): 529-557.
[8] ANDREW C D, PRENDERGAST M E, ALXE J H, etal. Bioprinting for the Biologist [J]. Cell, 2021, 184(1):18-32.
[9] 胡堃, 危巖, 李路海, 等. 3D打印技術在生物醫用材料領域的應用[J]. 新材料產業, 2014, (8): 33-39.
HU Kun, WEI Yen, LI Lu-hai, et al. Application of3D Printing Technology in Biomedical Materials [J].Advanced Materials Industry, 2014, (8): 33-39.
[10] 王維治, 宮玲, 李文玉, 等. 3D打印技術在醫學領域的應用[J]. 中國社區醫師, 2018, 34(29): 16-18.
WANG Wei-zhi, GONG Ling, LI Wen-yu, et al.Application of 3D Printing Technology in Medical Field[J]. Chinese Community Doctors, 2018, 34(29): 16-18.
[11] 張亮, 邱宏. 3D打印技術在醫學領域的應用[J]. 中國醫學裝備, 2018, 15(6): 154-157.
ZHANG Liang, QIU Hong. The Application of 3DPrinting Technique on the Medical Field [J]. ChinaMedical Equipment, 2018, 15(6): 154-157.
[12] RAMAN R, BASHIR R. Stereolithographic 3DBioprinting for Biomedical Applications [M]. Essentialsof 3D Biofabrication and Translation, 2015: 89-121.
[13] WANG Z J, ABDULLA R, PARKER B, et al. A Simpleand High-Resolution Stereolithography-Based 3DBioprinting System Using Visible Light Crosslinkable
Bioinks [J]. Biofabrication, 2015, 7(4): 045009.
[14] PENG Z, HAOXUAN W, PENG W, et al. Lightweight3D Bioprinting with Point by Point Photocuring [J].Bioactive Materials, 2021, 6(5): 1402-1412.
[15] YUAN S, KANG Y, JING N, et al. Modeling thePrintability of Photocuring and Strength AdjustableHydrogel Bioink during Projection-based 3DBioprinting [J]. Biofabrication, 2021, 13(3): 035032.
[16] BERNAL P N, DELROT P, LOTERIE D, et al.Volumetric Bioprinting of Complex Living-TissueConstructs within Seconds [J]. Advanced Materials,2019, 31(42): 1904209.
[17] XU H, CASILLAS J, KRISHNAMOORTHY S, et al.Effects of Irgacure 2959 and Lithium Phenyl-2,4,6-trimethylbenzoylphosphinate on Cell Viability, Physical
Properties, and Microstructure in 3D Bioprinting ofVascular-Like Constructs [J]. Biomedical Materials,2020, 15(5): 55012-55021.
[18] HE Y, YANG F F, ZHAO H M, et al. Research onthe Printability of Hydrogels in 3D Bioprinting [J].Scientific Reports, 2016, 6(6): 29977.
[19] ZHAO Y, TAO X, LI X, et al. Novel Self‐Initiating UVCurableAcrylate Monomers [J]. Journal of AppliedPolymer Science, 2020, 137(44): 49356.
[20] NIE J, FU J, HE Y. Hydrogels: The Next GenerationBody Materials for Microfluidic Chips? [J]. Small,2020, 16(46): 2003797.
[21] BEDELL M L, NAVARA A M, DU Y Y, et al. PolymericSystems for Bioprinting [J]. Chemical Reviews, 2020,120(19): 10744-10792.
[22] XUAN L, JIE T, JINLU L, et al. 3D Printing EnabledCustomization of Functional Microgels [J]. ACSApplied Materials & Interfaces, 2019, 11(13): 12209-12215.
[23] KIM S H, YEON Y K, LEE J M, et al. PreciselyPrintable and Biocompatible Silk Fibroin Bioinkfor Digital Light Processing 3D Printing [J]. NatureCommunications, 2018, 9(1): 1620.
[24] MAU R, NAZIR J, JOHN S, et al. Preliminary Studyon 3D Printing of PEGDA Hydrogels for Frontal SinusImplants Using Digital Light Processing (DLP) [J].
Current Directions in Biomedical Engineering, 2019,5(1): 249-252.
[25] WANG P, BERRY D, SONG Z, et al. 3D Printingof a Biocompatible Double Network Elastomer withDigital Control of Mechanical Properties [J]. Advanced
Functional Materials, 2020: 1910391.
[26] HUANG X, ZHANG Y, LI F, et al. Highly EfficientAlginate‐Based Macromolecular Photoinitiator forCrosslinking and Toughening Gelatin Hydrogels [J].Journal of Polymer Science, 2020, 58(10): 1439-1449.
[27] BAUMGARTNER S, GMEINER R, SCHÖNHERRJ A, et al. Stereolithography-Based AdditiveManufacturing of Lithium Disilicate Glass Ceramicfor Dental Applications [J]. Materials Science &Engineering C, 2020, 116: 111180.
[28] XU H, CASILLAS J, KRISHNAMOORTHY S, etal. Effects of Irgacure 2959 and Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate on Cell Viability,Physical Properties, and Microstructure in 3DBioprinting of Vascular-Like Constructs [J]. BiomedicalMaterials, 2020, 15(5): 55012-55021.
[29] 龔佳幸. 基于DLP打印技術的組織工程牙髓重建及其生物學性能評估[D]. 杭州: 浙江大學, 2020.
GONG Jia-xing. Tissue Engineered EndodonticReconstruction Based on DLP Printing Technology andBiological Performance Evaluation [D]. Hangzhou:Zhejiang University, 2020.
[30] CHEN Y, ZHANG J, LIU X, et al. Noninvasive in Vivo3D Bioprinting [J]. Science Advances, 2020, 6(23):a7406.
[31] KAI L, FANGYUAN Z, DAZHI W, et al. Silkworm-Inspired Electrohydrodynamic Jet 3D Printing ofComposite Scaffold with Ordered Cell Scale Fibers forBone Tissue Engineering [J]. International Journal ofBiological Macromolecules, 2021, 172: 124-132.
[32] YE W, LI H, YU K, et al. 3D Printing of GelatinMethacrylate-Based Nerve Guidance Conduits withMultiple Channels [J]. Materials & Design, 2020, 192:
108757.
[33] KRKOBABIĆ M, MEDAREVIĆ D, CVIJIĆ S, et al.Hydrophilic Excipients in Digital Light Processing(DLP) Printing of Sustained Release Tablets: Impacton Internal Structure and Drug Dissolution Rate [J].International Journal of Pharmaceutics, 2019, 572:118790.
[34] YANG Y, ZHOU Y J, LIN X, et al. Printability ofExternal and Internal Structures Based on Digital LightProcessing 3D Printing Technique [J]. Pharmaceutics,
2020, 12(3): 207-223.
[35] ZHOU F, YI H, LIANG R, et al. Rapid Printing of Bioinspired3D Tissue Constructs for Skin Regeneration [J].Biomaterials, 2020, 258: 120287.
[36] PAUNOVI N, BAO Y, COULTER F B, et al. DigitalLight 3D Printing of Customized BioresorbableAirway Stents with Elastomeric Properties [J]. Science Advances, 2021, 7(6): e9499.
[37] MIN T, QI X, C G R, et al. Three-DimensionalBioprinted Glioblastoma Microenvironments ModelCellular Dependencies and Immune Interactions [J].
Cell Research, 2020, 30(10): 833-853.
[38] BAUMGARTNER S, GMEINER R, SCHNHERR J A,et al. Stereolithography-Based Additive Manufacturingof Lithium Disilicate Glass Ceramic for Dental Applications [J]. Materials Science and Engineering C,2020, 116: 111180.
[39] SHAO H, KE X, LIU A, et al. Bone Regeneration in 3DPrinting Bioactive Ceramic Scaffolds with ImprovedTissue/Material Interface Pore Architecture in Thin-Wall
Bone Defect [J]. Biofabrication, 2017, 9(2): 025003.
[40] 胡堃, 王坤蘭, 崔玉珠, 等. 3D打印礦化膠原基骨修復體降解及其生物學性能研究[J]. 數字印刷, 2021, (3):147-157.
HU Kun, WANG Kun-lan, CUI Yu-zhu, et al. Study on the Degradation and Biological Properties of 3D Printing Mineralized Collagen-Based Bone Repair Materials [J]. Digital Printing, 2021, (3): 147-157.
[41] 胡堃, 王峻東, 楊桂娟, 等. 3D打印智能仿生材料研究進展[J]. 數字印刷, 2020, (5): 1-15.
HU Kun, WANG Jun-dong, YANG Gui-juan, et al. Research Progress of 3D Printing Smart Bionic Materials [J]. Digital Printing, 2020, (5): 1-15.
[42] XIN S, TING W, SHU G. Applications of 3D Printed Bone Tissue Engineering Scaffolds in the Stem CellField [J]. Regenerative Therapy, 2021, 16: 63-72.
[43] XIA H, ZHAO D, ZHU H, et al. Lyophilized ScaffoldsFabricated from 3D-Printed Photocurable NaturalHydrogel for Cartilage Regeneration [J]. ACS Applied
Materials & Interfaces, 2018, 10(37): 31704-31715.
[44] QIAO U, LIU X, ZHOU X, et al. Gelatin TemplatedPolypeptide Co-Cross-Linked Hydrogel for BoneRegeneration [J]. Advanced Healthcare Materials, 2020,
9(1): e1901239.
[45] 胡苗苗, 胡堃, 崔玉珠, 等. 3D打印溫敏性透明質酸基水凝膠研究[J]. 數字印刷, 2019, (6): 72-76.
HU Miao-miao, HU Kun, CUI Yu-zhu, et al.Preparation and Study of 3D Printing Thermosensitive Hyaluronic Acid-Based Hydrogels [J]. Digital Printing,2019, (6): 72-76.
[46] 陳清華. 基于光固化3D打印的顱骨植入物制備及其生物活性研究[D]. 濟南: 山東大學, 2020.
CHEN Qing-hua. Preparation and Bioactivity of SkullImplants Based on Stereolithography [D]. Jinan:Shandong University, 2020.
[47] ZHANG M, LIN R, WANG X, et al. 3D Printing ofHaversian Bone–Mimicking Scaffolds for MulticellularDelivery in Bone Regeneration [J]. Science Advances,
2020, 6(12): eaaz6725.
[48] KOFFLER J, ZHU W, QU X, et al. Biomimetic3D-Printed Scaffolds for Spinal Cord Injury Repair [J].Nature Medicine, 2019, 25(2): 263-269.
[49] WANG P, BERRY D, MORAN A, et al. ControlledGrowth Factor Release in 3D‐Printed Hydrogels [J].
Advanced Healthcare Materials, 2020, 9(15): 1900977.[50] LING Z, CHUNMEI L, YIMEI L, et al. DiverseTreatments for Deep Burn Wounds: A Case Report [J].
Advances in Skin & Wound Care, 2021, 34(4): 1-6.
[51] SI X, XIANZHU Z, PING L, et al. A Gelatin-SulfonatedSilk Composite Scaffold Based on 3D PrintingTechnology Enhances Skin Regeneration by Stimulating
Epidermal Growth and Dermal Neovascularization [J].Scientific Reports, 2017, 7: 1-12.
[52] YING W, JINMING X, QI W, et al. ClinicalComparison of Airway Stent Placement in InterventionRoom and Operating Room [J]. Chinese Journal of Lung Cancer, 2020, 23(6): 451-459.
[53] SAHU S, MADAN K, MOHAN A, et al. Obstructive Fibrinous Tracheal Pseudomembrane Following Tracheal Stent Placement: An under Recognized Entity
[J]. Lung India, 2020, 37(5): 529-530.
[54] MELGOZA E L, VALLICROSA G, SERENÓ L,et al. Rapid Tooling Using 3D Printing System forManufacturing of Customized Tracheal Stent [J]. Rapid Prototyping Journal, 2014, 20(1): 1355-2546.
[55] HEE K S, KYU Y Y, MIN L J, et al. Precisely Printable and Biocompatible Silk Fibroin Bioink for Digital Light Processing 3D Printing [J]. Nature Communications,
2018, 9(1): 1-14.
[56] KIM S H, SEO Y B, YEON Y K, et al. 4D-Bioprinted Silk Hydrogels for Tissue Engineering [J]. Biomaterials,2020, 260: 120281.
[57] LIU J, YAO X, WANG Z, et al. A Flexible Porous Chiral Auxetic Tracheal Stent with Ciliated Epithelium[J]. Acta Biomaterialia, 2021, 124(1): 153-165.
[58] ZHOU G, HAN Q Y, TAI J, et al. Digital Light Procession Three-Dimensional Printing Acrylate/Collagen Composite Airway Stent for Tracheomalacia [J]. Journal of Bioactive and Compatible Polymers,2017, 32(4): 429-442.
[59] M O N E T R L , J E N N I F E R M . M o d u l a t i n g Microenvironments for Treating Glioblastoma [J].Current Tissue Microenvironment Reports, DOI:
10.1007/s43152-020-00010-z.
[60] PANG Y, MAO S S, YAO R, et al. TGF-β InducedEpithelial-Mesenchymal Transition in an AdvancedC e r v i c a l Tu m o r M o d e l b y 3 D P r i n t i n g [ J ] .
Biofabrication, 2018, 10(4): 044102.
主要作者
王贊(1978年-), 博士,副教授;主要研究方向為生物3D打印、智能制造。
WANG Zan, born in 1978. He got thedoctor degree and now is an assistantprofessor. His main research interests arebioprinting and intelligent manufacturing.
王金武(1971年-),博士,教授,主任醫師;主要研究方向為3D打印康復輔具與骨關節內植物3D打印的臨床轉化,通過顯微外科和定制式人工關節技術進行肩關節腫瘤的保肢治療。
WANG Jin-wu, born in 1971. He got the doctor degree and nowis a professor and chief physician. His research directions areclinical transformation of 3D printing rehabilitation aids andbioprinting of bone and joint plants, and limb salvage treatmentof shoulder joint tumors through microsurgery and customizedartificial joint technology.
相關鏈接











